Thèse de
Chimie et de Physique présentée à Faculté des Sciences de Paris
par ¶
Gustave
Chancel
Recherches
sur la formation et la constitution des produits pyrogénés
soutenue le
17 avril 1848
DÉVELOPPEMENTS
THÉORIQUES
Les
recherches qui font le sujet de cette thèse se rapportent principalement aux
acétones, à cette série de combinaisons qui prennent toujours
naissance dans la distillation sèche des acides monobasiques homologues de
l'acide acétique (série RO2). Les composés de cette classe, sans
contredit l'une des plus intéressantes de la chimie des produits
pyrogénés, n'ont été jusqu'à présent, malgré la netteté des réactions
qui les engendrent, liés à aucun principe rationnel qui puisse donner
une idée de leur constitution : en abordant ce sujet, je ne me trouve
donc en opposition avec aucune théorie déjà existante.
M.
Kane, à la vérité, en assimilant l'acétone aux alcools, a émis des vues
théoriques sur la constitution de ce composé; mais cette théorie n'a pas
un seul fait à son appui et se trouve même en contradiction avec les
caractères fondamentaux des acétones et des alcools. Je
m'abstiendrai, d'ailleurs, de la discuter, M. Liebig ayant déjà eu occasion de la
combattre. La seule opinion qui ait été émise depuis sur la constitution des
acétones, et qui me paraît entièrement rationnelle, c'est celle de M.
Gerhard. Ce chimiste en fait une classe à part, celle des complications,
c'est-à-dire des corps naissant de la métamorphose de deux ou de plusieurs
molécules, renfermant encore le résidu d'une de ces molécules, et
susceptibles, par conséquent, de la régénérer. Cette idée, à laquelle M.
Gerhardt n'a pas donné de plus amples développements pour le cas particulier
des acétones, m'a néanmoins servi de base dans ces recherches, et je crois
être parvenu à bien préciser les relations qui rattachent cette classe de
corps aux autres composés de la chimie.
Dans
ce travail, je n'examinerai d'ailleurs que les produits pyrogénés qui
dérivent des acides monobasiques homologues de l’acide acétique (dans lesquels
on observe, entre le nombre des équivalents de carbone et d'hydrogène, le
rapport constant 1:2). Chacun de ces acides donne lieu à deux réactions
bien distinctes, suivant le mode de distillation sèche dont on fait usage :
dans l'une, il y a formation d'un hydrocarbure; dans l'autre, on obtient une
combinaison oxygénée. Je vais chercher successivement à déterminer le
caractère de la distillation sèche dans les deux cas qui viennent d'être
signalés.
Afin
d'éviter les périphrases et de mettre plus de clarté dans cet exposé, il sera
nécessaire de poser une définition purement conventionnelle et indépendante
de toute idée systématique. Tous les acides que nous aurons à examiner,
appartiennent à autant de séries parallèles, dont la première est la série méthylique
(acide formique), et la dernière, la série stéarique (acide stéarique).
Chacune de ces séries peut présenter deux hydrocarbures : le premier a
toujours une forme analogue à celle du gaz oléfiant (C2H4), c'est-à-dire que
les équivalents de carbone et d'hydrogène sont entre eux dans le rapport
simple de 1:2 ; je les désignerai collectivement sous le nom d'hydrocarbures
simples. Les seconds sont analogues au gaz des marais, ils renferment
constamment 2 équivalents d'hydrogène de plus que les hydrocarbures
simples; ce seront les perhydrocarbures. Le perhydrocarbure d'une série
renferme donc 2 équivalents d'hydrogène de plus que l'hydrocarbure simple de la
même série.
L'acide
acétique, ou ce qui revient au même, l'acétate de soude cristallisé,
chauffé en présence d'un grand excès de baryte, perd tout son oxygène
à l'état d'anhydride carbonique, et donne naissance au gaz des
marais, qui appartient à la série méthylique. Les acides métacétique,
butyrique, valérique, stéarique, etc., subiraient, dans les mêmes
circonstances, une décomposition analogue, et l'on obtiendrait ainsi une
série d'hydrocarbures présentant tous une forme semblable à celle du gaz des
marais ; on a, en effet
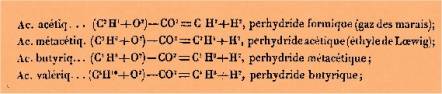
Pour
donner à ces faits une interprétation générale, représentons par D le plus simple des hydrocarbures == CH2; la formule générale des acides
monobasiques homologues de l’acide acétique sera
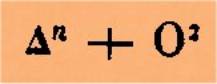
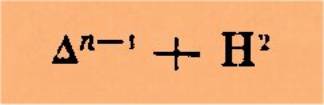
Un
acide de cette forme, en perdant tout son oxygène à l'état d'anhydride
carbonique, engendrera toujours, comme nous venons de le voir, un
perhydrocarbure, dont la composition s'exprimera par :
Ainsi,
dans une distillation sèche de cette nature, il y a passage complet de la
série à laquelle appartient cet acide, à la série immédiatement antérieure.
Cette formule générale nous apprend en outre que :
Pour obtenir un perhydrocarbure dans une
série n, il faudra enlever tout l'oxygène, sous forme d'anhydride carbonique,
à l'acide mono-basique de la série n -+-1
Si
nous ramenons la formule générale des acides monobasiques au cas particulier
de l’acide formique, n devient égal à 1i, et, par suite, n - 1 = 0. Ce qui
fait voir que si, par la distillation sèche, on enlève à l’acide formique
tout son oxygène à l’état d'anhydride carbonique, on obtiendra, comme unique
produit pyrogéné, de l'hydrogène pur. C'est là, en effet, ce que démontrent
des expériences déjà fort anciennes de M. Pelouze.
L'acétone
est un corps type d'une série de combinaisons dans laquelle viennent se
ranger la métacétone, la butyrone, la valérone, etc. En examinant de près les
réactions communes à ces substances, il est facile de se convaincre qu'elles ne
constituent pas des composés simples tels que les alcools, les acides ou les
aldéhydes, capables de fournir des dérivés faisant toujours partie de la
même série; mais ce sont, au contraire, comme je vais essayer de le
démontrer, des combinaisons oxygénées complexes, qui résultent de la juxtaposition
des hydrocarbures simples de deux séries différentes.
Il
résulte de cette juxtaposition même, que les produits pyrogénés de cette
classe présentent une apparence de complication qui semble entièrement les
exclure de la série de l’acide qui leur a donné naissance. Mais les acétones ne
sont évidemment pas des molécules simples, la nature de leur réaction ne permet pas
le moindre
doute à cet égard ; il suffit de remarquer qu'elles sont toujours inertes à
l'égard des agents faibles, tandis que l'emploi des agents
énergiques les dédouble en général et les ramène à la série de l’acide qui a
servi à les produire.
Ainsi,
MM. Dumas et Stas ont démontré que l'acétone se transforme en acide acétique
sous l'influence de l’acide chromique étendu ; c'est avec le même réactif que M.
Gottlieb a obtenu un nouvel acide en oxydant la métacétone. Je me suis
assuré, de mon côté, de la formation de l’acide butyrique dans l'action des corps
oxydants sur la butyrone. Enfin, M. Dumas a constaté que l'acétone soumise à
l'action de la chaux potassée donne à la fois du formiate et de l'acétate. Ces faits,
auxquels on pourrait en joindre plusieurs autres, suffisent pour mettre en
évidence le lien intime qui unit chacun des composés de la classe des
acétones à la série de l’acide qui a servi de point de départ. Jetons
maintenant un coup d'œil sur le principe qui préside à la formation de ces
substances.
Il
résulte d'un grand nombre de faits, qu'une distillation sèche n'est autre
chose qu'un procédé de réduction ; c'est un véritable acte de combustion
qui se fait aux dépens des éléments de la matière organique. Or,
si à un acide monobasique on pouvait enlever i équivalent d'oxygène sans
toucher au carbone et à l'hydrogène, il est évident que l'on formerait
l'aldéhyde de cet acide car :
Un aldéhyde est un composé neutre qui ne diffère de son acide que par l'équivalent
d'oxygène en moins, et qui peut toujours régénérer cet acide par une
simple fixation d'oxygène.
Eh bien, ces
aldéhydes qu'on a cru, jusqu'à ce jour, ne pouvoir obtenir que
d'une manière indirecte, peuvent cependant être engendrés par la réduction de
l'acide même, et cela précisément dans une distillation sèche. Assez
fréquemment, il est vrai, ces aldéhydes ne s'obtiennent pas libres, mais
seulement en combinaison avec un hydrocarbure qui se forme simultanément;
ce sont ces combinaisons, comme nous allons le voir, qui constituent les
acétones.
Nous
venons de rappeler que les acétones sont des produits de réduction qui
conservent toujours, malgré leur apparence de complication, l'empreinte de
leur origine, au point que, placés dans des circonstances opposées à celles
qui leur ont donné naissance, c'est-à-dire sous l'influence d'actions
oxydantes, elles régénèrent toujours leur produit primitif. Si nous ajoutons
que les aldéhydes et les acétones possèdent ce caractère commun de régénérer
le même acide ; enfin, que deux de ces aldéhydes, le butyral et le valéral, qui
présentent avec l'aldéhyde acétique l'analogie la plus parfaite, prennent
naissance dans une distillation sèche par suite du dédoublement de
la butyrone et de la valérone; on ne pourra, je pense, se refuser à l'idée que
chacun des composés de la classe des acétones renferme deux groupes
moléculaires distincts, dont l'un comprend les éléments de l'aldéhyde de
l'acide qui lui a donné naissance. En dédoublant les formules des acétones, d'après
ce point
de vue, voici les relations que l'on observe :

........... et ainsi de
suite pour toutes les acétones des acides homologues de l'acide acétique.
Les
relations entre les divers acides monobasiques, leurs aldéhydes et leurs
acétones, qui sont mises en évidence dans le tableau précédent,
peuvent maintenant recevoir une interprétation générale.
Représentons
toujours par Dn un hydrocarbure simple (D =CH2); la formule des acides sera
Dn + O2
et
celle des aldéhydes correspondant à l'acide,
Dn + O
Dès lors la formule générale des
acétones sera
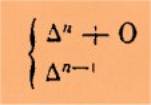
Nous sommes donc conduit à la règle suivante :
L'acétone d'une série peut être représentée par l'union de
l'aldéhyde de cette série avec l'hydrocarbure
simple de la série immédiatement antérieure.
Ainsi,
la distillation sèche d'un acide monobasique présente deux cas bien distincts ;
dans l'un et l'autre il y a réduction de l'acide et l'oxygène
éliminé brûle une partie de ses éléments. Si cette réduction est complète, il
se forme un perhydrocarbure, et il y a passage complet de la série à laquelle
appartient cet acide à la série antérieure. Lorsqu'au contraire on
n'enlève qu'une partie de l'oxygène de l'acide sous forme d'eau et
d'anhydride carbonique, 2 équivalents de l'acide prennent part à la réaction,
et l'on obtient une acétone : on reste, alors, dans la série à laquelle appartient
l'acide, tout en passant partiellement à la série antérieure.
Cette
réaction complexe, qui donne naissance aux composés de la classe des
acétones, peut s'exprimer d'une manière très-simple par une double
équation. Prenons pour exemple la distillation sèche de l'acide butyrique ou
des butyrates, 2 équivalents d'acide prenant part à la réaction ; on a :
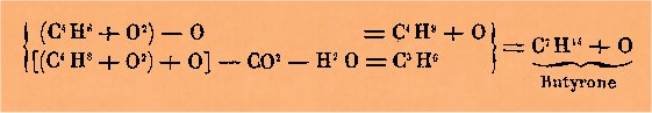
En
opérant sur de faibles quantités de butyrate, on obtient de la butyrone presque
pure, si l'on a soin de conduire la distillation avec une grande régularité;
mais, lorsqu'on élève trop la température, la butyrone formée se dédouble en
aldéhyde butyrique et en un hydrocarbure simple (le métacétène = C3H6?). Cette
circonstance rend compte de la formation de l'hydrocarbure que j'ai obtenu
dans la plupart des préparations de butyrone.
En
appliquant la règle précédente au cas particulier de l’acide formique, qui
appartient à la première de tontes ces séries, nous voyons que
l'hydrocarbure simple, qu'il faut ajouter à l'aldéhyde formique pour
avoir la formone, est nul ; nous arrivons donc à cette conclusion, que
L’aldéhyde formique et la formone ne doivent être qu'une seule et même substance.
Ce
résultat est d'ailleurs immédiatement mis en évidence par la formule générale
des acétones; car, dans le cas de l’acide formique, n= 1, et, par
conséquent, n— 1 = 0, c'est-à-dire que Dn-1 devient nul.
Enfin,
nous sommes encore conduit à la même conséquence par les relations
ordinaires appliquées au cas qui nous occupe ; ainsi on a :
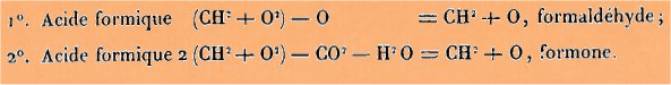
Bien
que l'aldéhyde formique ou la formone reste encore à dé-couvrir, il est
impossible de contester la probabilité de réactions aussi simples,
et de la nature de toutes celles qui ont été observées jusqu'à ce jour.
Ainsi,
la série des aldéhydes ne diffère de celle des acétones qu'en ce que la
première renferme les aldéhydes simples, et la seconde ces mêmes aldéhydes
combinés; ces deux séries sont liées l'une à l'autre par le premier terme,
qui doit être tout à la fois un aldéhyde et une acétone.
La
théorie dont je viens de présenter l'exposé ne repose, comme on le voit, sur
aucune hypothèse gratuite; elle n'a d'autre base que l'ensemble des faits
observés par un grand nombre de chimistes. Les formules générales qui en
découlent rendent compte de la formation des produits pyrogénés, du caractère
de la dissolution sèche, et permettent de saisir les relations spéciales qui
affectent certains cas particuliers.
La règle concernant les acétones
assigne à ces substances une forme générale, et définit leur nature chimique en
démontrant qu'elles ne doivent pas être considérées comme des composés simples,
mais qu'il faut les assimiler à des combinaisons complexes, telles,
par exemple,
que les éthers composés. Enfin, elle nous apprend que ces substances
appartiennent toujours à la série de l'acide qui les a engendrées,
met en évidence le lien qui les unit à cet acide, et détermine la
place qu'elles occupent dans la série.
Mots clefs : hydrocarbure / sèche /
distillation / composé / acétone / aldéhyde / oxygène / réaction / monobasique / formule /
formique / combinaison / classe / acétique / hydrogène / butyrone / acide / réduction /
perhydrocarbure / carbonique / anhydride / pyrogénation / butyrique / stéarique / molécule /
marais / formone / complexe / carbone / analogue / alcool / valérone / recherche / méthylique /
métacétone / gerhardt / dumas / chimie / butyrate / acétate / chancel